
CPAP nel neonato: applicazioni e limiti
Dott.
Gianfranco Maffei
Dirigente Medico U.O. di Terapia Intensiva Neonatale, Policlinico di Foggia,
Italy
Vol. 2, N. 1, Gennaio 2004
La CPAP (Continuous Positive Airways Pressure) insieme alla PEEP (Positive End Expiratory Pressure) rappresentano le principali modalità di applicazione di una Pressione Continua di Distensione Polmonare (CDP) (1). La prima si differenzia in quanto applicata ad un neonato in respiro spontaneo. L'applicazione di una pressione positiva per tutto il ciclo respiratorio, consente il progressivo reclutamento di alveoli, garantendo un grado di ossigenazione direttamente proporzionale alla pressione applicata. Anche la rimozione della CO2 è direttamente correlata al grado di reclutamento alveolare, ma per CPD elevate è possibile la riduzione del gradiente pressorio tra inspirazione ed espirazione con conseguente riduzione dei volumi correnti e quindi dell'eliminazione della CO2.
Basi fisiologiche d'impiego
Il lavoro respiratorio (Work Of Breathing - WOB) compiuto dal neonato per espandere il sistema toraco-polmonare è strettamente correlato alle proprietà elastiche e resistive del sistema stesso. Il neonato prematuro, presenta un aumento di tale lavoro poiché:
1. le proprietà elastiche polmonari sono ridotte (bassa Compliance per patologia restrittiva da carenza di surfattante);
2. le proprietà resistive si presentano aumentate per concomitante patologia ostruttiva;
3. la compliance della gabbia toracica è aumentata.
Una delle finalità della CPAP è poter ridurre tale lavoro respiratorio.
1. Forze elastiche polmonari
La Compliance polmonare (rV/rP) nel prematuro si presenta ridotta in quanto:
• vi è deficit quantitativo di surfattante con aumento della tensione superficiale polmonare, il che condiziona una riduzione della Capacità Funzionale Residua (CFR)
• vi è una eccessiva quantità di liquido a livello polmonare: la sua clearance è più lenta nel prematuro, specie se nato da taglio cesareo.
2. Resistenze delle vie aeree (Raw)
Le resistenze delle vie aeree descrivono la intrinseca capacità del sistema di conduzione e dei tessuti ad opporsi al flusso gassoso ed è espressa come variazione di pressione per unità di variazione di flusso ( rP/rFl).
Esse resistenze dipendono da:
• raggio delle vie aeree (area totale di sezione);
• lunghezza delle vie aeree;
• velocità di flusso;
• densità e viscosità del gas
Tranne che nel broncospasmo, nell'edema della mucosa o interstiziale, le vie aeree distali normalmente contribuiscono poco alle resistenze totali poiché notevole è la loro area totale di sezione. Tuttavia nel prematuro, esse possono incidere in quanto la struttura architettonica polmonare può non essere in grado di mantenere pervie le piccole vie aeree; inoltre va aggiunto che la ridotta CFR può anche contribuire alla riduzione del loro calibro.
Le resistenze delle vie aeree prossimali, invece, specie nei prematuri possono presentarsi aumentate in quanto:
• manca la fascia di tessuto adiposo superficiale del collo che stabilizza e mantiene pervie le prime vie aeree (2, 3) ;
• risulta ridotta la contrattilità del muscolo genioglosso che normalmente stabilizza il faringe (4);
• il loro diametro si presenta ridotto rispetto al neonato a termine.
3. Compliance della gabbia toracica
La Compliance della parete toracica si correla all'età gestazionale del neonato, nel senso che quanto più questi è prematuro, tanto più deformabile sarà il suo torace. Essa, infatti è circa 5 volte superiore a quella polmonare nel prematuro senza RDS e circa 3 volte superiore nel neonato a termine sano. Nell'adulto il rapporto è di 1:1 (5). Nel prematuro quindi, questa particolare cedevolezza della gabbia toracica condiziona una inadeguata pressione transpolmonare a fine espirazione ed una riduzione della CFR (ventilazione a volumi vicini a quelli di chiusura con collasso alveolare e squilibrio ventilo-perfusorio).
Altri fattori strutturali della parete toracica incidono negativamente sulla meccanica ventilatoria:
• andamento orizzontale delle coste, con ridotta escursione nell'ispirazione;
• appiattimento della cupola diaframmatica con accorciamento delle fibre muscolari e quindi minor forza contrattile;
Alla riduzione della CFR, il neonato fa fronte con la parziale chiusura dell'epiglottide in espirazione (gemito), ma il prematuro spesso non riesce a metterelo in atto o a mantenerlo nel tempo, per l'inadeguato tono laringeo.
Oltre al gemito, altri 2 meccanismi intervengono in corso di RDS per aumentare la CFR:
• contrazione dei muscoli inspiratori durante la prima fase dell'espirazione;
• inizio dell'inspirazione prima del termine della fase espiratoria: tale strategia pur aumentando la CFR e facilitare lo scambio gassoso, risulta svantaggioso dal punto di vista del dispendio energetico (6).
Non va dimenticato, infine che la una riduzione della CFR porta il neonato a lavorare nella parte bassa della curva volume/pressione (Fig. 1) costringendolo a sviluppare elevate pressioni a fronte di modesti incrementi di volume. L'applicazione, quindi, di una pressione positiva continua nelle vie aeree (CPAP) amplifica quelle strategie messe in atto dal neonato spontaneamente al fine di mantenere un adeguato volume di fine espirazione, minimizzando le energie spese per stabilizzare il sistema respiratorio e per eseguire il lavoro meccanico della respirazione.
In sintesi, quindi la CPAP è in grado di:
1. aumentare la CFR attraverso reclutamento di alveoli collassati permettendo di lavorare nella parte media della curva V/P con minor dispendio energetico;
2. ridurre le resistenze nelle vie aeree in quanto stabilizza le stesse prevenendone il collasso. E' stato riportato in fase inspiratoria, un aumento del rapporto larghezza/lunghezza della laringe dal 12,5 al 47% in seguito all'applicazione della CPAP (7);
3. ridurre lo shunt intra-polmonare destro-sinistro grazie al miglioramento dell'ossigenazione ed alla vasodilatazione del piccolo circolo;
4. stabilizzare la parete toracica riducendone il collasso inspiratorio ed abolendo altresì il riflesso inibitorio frenico-intercostale dell'inspirazione (8);
5. rallentare la frequenza respiratoria (8) per prolungamento del tempo espiratorio conseguenza dell'abolizione del riflesso di deflazione di Hering-Breuer;
6. aumentare la pressione media nelle vie aeree (Mean Airways Pressure – MAP) migliorando il rapporto ventilazione-perfusione;
7. mantenere il surfattante sulla superficie degli alveoli;
8. diminuire l'edema alveolare, ove fosse presente.
La CPAP in definitiva aumenta l'ossiemia attraverso molteplici meccanismi (aumento della CFR, della MAP, miglioramento del rapporto V/Q); inoltre, entro certi limiti si dimostra anche in grado di ridurre la capnia ed il lavoro respiratorio.(9)
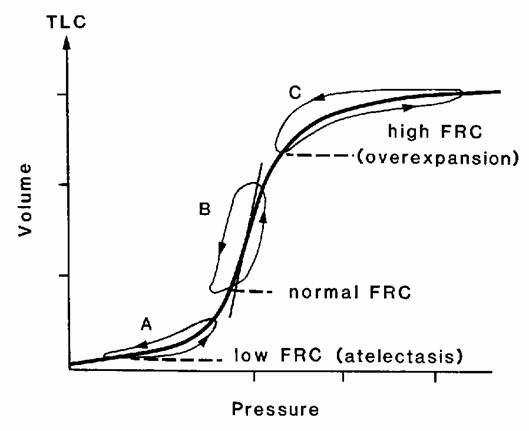 |
Fig. 1 Curva Volume/Pressione
Modalità d'applicazione della CPAP
Bisogna fare una differenziazione sostanziale fra sistemi convenzionali, i quali si differenziano essenzialmente per i diversi tipi d'interfaccia impiegati tra circuito a pressione positiva continua e neonato (tubo endotracheale, naso-faringeo, cannule nasali, maschera facciale, camera facciale etc.) e nuovo sistema detto Infant Flow.
Nel primo caso, la pressione positiva è generata nel circuito dirigendo un flusso d'aria contro una resistenza sul tratto espiratorio (valvola espiratoria). Questa modalità si accompagna a perdite del gas respiratorio dal collegamento nasale o dalla bocca del paziente ed inoltre bisogna considerare l'incremento delle resistenze al flusso stesso da parte dei connettori nasali. Questi sistemi inoltre si associano a fluttuazioni ampie della pressione nelle vie aeree durante le fasi ventilatorie. Questo tipo di CPAP (convenzionale) può essere erogata mediante:
• Tubo endotracheale: applicata durante le fasi di svezzamento dalla ventilazione meccanica, oggi è in disuso per le aumentate resistenze offerte dal tubo endotracheale (direttamente proporzionali alla lunghezza ed inversamente proporzionali al quadrato del raggio) e quindi per il notevole aumento del lavoro respiratorio.
• Head Box: di interesse storico. Si tratta di un sistema rumoroso ed ingombrante per la somministrazione della CPAP che utilizza una campana a tenuta intorno al collo del neonato.
• Maschera facciale: difficilmente applicabile al neonato prematuro per la scarsa tenuta della maschera e per la difficoltà di generare un soddisfacente livello di CPAP anche a flussi elevati.
• Cannula nasofaringea (CPAP mono-nasale): un tubo endo-tracheale è posizionato tramite una narice fino alla faringe. Tecnica semplice ed attualmente impiegata per il trattamento di forme lievi di distress respiratorio o di apnee della prematurità. Gli svantaggi risiedono nel fatto che le resistenze attraverso questa cannula, soprattutto se di piccolo calibro, sono elevate e che essa by-passa totalmente il sistema di umidificazione-riscaldamento rappresentato dalla mucosa naso-faringea.
• Cannule nasali (naso-cannule): rappresenta attualmente il metodo più diffuso per somministrare CPAP nel neonato. Le cannule nasali sono facile applicazione e certamente meno invasive rispetto al tubo endotracheale.
Al fine di ottenere una minore variabilità pressoria nelle vie aeree, oltre che minimizzare l'impedenza alla ventilazione stessa, è stato progettato un nuovo sistema in cui la pressione positiva viene generata attraverso un effetto Venturi che utilizza un flusso stagnante a livello del connettore di raccordo con il paziente (Infant flow system) Fig.2. Tale connettore prevede 3 aperture: una collegata alle cavità nasali, una alla fonte dei gas ad alta pressione ed una aperta all'ambiente.
In pratica, la miscela gassosa umidificata è erogata attraverso due iniettori jet e convogliata verso le aperture nasali dove, proprio a tal livello, l'energia cinetica del flusso è convertita in pressione (10). Non esistono pertanto valvole meccaniche poste sul tratto espiratorio che si apre liberamente all'esterno; inoltre la specifica configurazione geometrica dei canali angolati (iniettori Jet) riduce al minimo l'impedenza al flusso.
Durante l'inspirazione, una bassa pressione nelle cavità nasali crea un gradiente positivo di pressione tra la sorgente jet e le cavità stesse per cui il flusso di gas fluisce verso queste ultime assistendo lo sforzo inspiratorio e minimizzando il lavoro. La struttura geometrica del connettore, inoltre, è tale da consentire che per ogni respiro il paziente riceve gas fresco piuttosto che quello espirato in precedenza.
Nel corso dell'espirazione, invece, si assiste ad un incremento della pressione all'interno della camera che altera la struttura geometrica del flusso jet per cui questi fluisce giù verso la branca espiratoria insieme con l'aria espirata dal paziente stesso.
Per la diminuita pressione vigente in prossimità delle pareti interne del connettore, la corrente del gas espirato scorre lungo tale percorso. Quest'effetto è conosciuto come “Effetto Coanda” e si è dimostrato in grado di determinare un trascinamento del gas espirato dal paziente verso l'esterno, assistendo quindi anche la fase espiratoria della ventilazione.
Diversi studi hanno dimostrato che con questo sistema si ha una riduzione maggiore del lavoro respiratorio rispetto ad una CPAP convenzionale, legata verosimilmente ad una minore fluttuazione pressoria nelle vie aeree (11,12).
 |
Fig. 2: Generatore Infant Flow
Indicazioni cliniche alla CPAP
Il distress respiratorio legato a carenza quantitativa di surfattante, rappresenta l'indicazione elettiva alla CPAP ed in particolare alla nasal CPAP. (13) Tale quadro clinico si caratterizza da un punto di vista fisiopatologici con:
• riduzione della compliance del polmone;
• riduzione della CFR;
• mismatch V/Q
• riduzione del Volume Corrente, legato alla plasticità della parete toracica dei prematuri che mal si oppone a dei polmoni poco complianti (14).
Tali condizioni conducono altre che ad un aumento del lavoro respiratorio anche a profonde alterazioni degli scambi gassosi, condizionando una insufficienza respiratoria ipossiemica-ipercapnica.
Altre indicazioni all'utilizzo della nCPAP sono rappresentate da:
- Apnee del prematuro: efficace soprattutto nel ridurre la componente ostruttiva del problema (14);
- Weaning respiratorio (post-estubazione): sia come momento unico che a seguire la SIMV. Davis P. et al. (15) hanno pubblicato un trial controllato e randomizzato sugli effetti della nCPAC nell'estubazione dei VLBWI, dimostrando che quando è applicata profilatticamente dopo l'estubazione tracheale, riduce l'incidenza di eventi clinici avversi, in particolare l'apnea, che conducono all'insuccesso dell'estubazione stessa.
- Tachipnea transitoria del neonato (TTN)
- Sindrome da aspirazione meconiale (SAM)
- Cardiopatie congenite
- Tracheo-broncomalacia
- Atelettasia
- Malattia Polmonare Cronica
- Bronchiolite (anche se alcuni Autori manifestano perplessità legate all'incremento dell'air trapping) (17);
- Paralisi del nervo frenico
NCPAP e neonati VLBW
Nella seconda metà degli anni 80, sono state pubblicate due indagini retrospettive multicentriche che riguardavano l'incidenza della malattia polmonare cronica nei VLBW, intesa come ossigeno-dipendenza a 28 giorni di vita. (18,19)
In ambedue i lavori veniva dimostrata come l'incidenza della malattia polmonare cronica, fosse più bassa, in maniera statisticamente significativa, in quei centri che impiegavano precocemente la NCPAP (“early NCPAP”) unitamente ad un management respiratorio di questi neonati che prevedeva tra l'altro il non uso di farmaci paralizzanti e la tolleranza di valori relativamente elevati di capnia (fino a 60 mmHg) senza procedere alla ventilazione meccanica previa intubazione oro-tracheale.
L'impiego precoce della NCPAP ("early NCPAP") in questa categoria di neonati, porterebbe gia dai primi minuti di vita all'acquisizione e mantenimento di un adeguata Capacità Funzionale Residua con conseguente miglioramento degli scambi gassosi, mantenimento di una normale interfaccia aria-liquido a livello degli alveoli terminali e liberazione delle riserve di surfattante polmonare. Ciò conduce, secondo diversi Autori, ad una riduzione del fabbisogno di ventilazione meccanica (20,21).
Secondo questa filosofia, l'intubazione e la ventilazione meccanica vengono riservate solo a quei neonati che presentano un fallimento alla NCPAP ovvero in caso di apnea intrattabile, insufficienza respiratoria ipercapnica (PaCO2 > 65-70 mmHg e pH < 7.20), richiesta di surfattante suppletivo.
Riguardo alla somministrazione di surfattante combinata con l'impiego della early NCPAP, Blennow M. et al. (22) nel 1999 ha proposto un nuovo tipo di approccio denominato “INSURE” (acronimo delle parole INtubation-SURfactant-Extubation).
La metodica prevede che un neonato sottoposto a NCPAP il quale presenta una richiesta di FiO2 > 60% e che quindi richieda indispensabilmente la somministrazione di surfattante, venga intubato e quindi riceva il surfattante, dopo di che viene estubato e posto nuovamente in NCPAP. Questa modalità di approccio combinato NCPAP-Surfattante, sembra in grado di ridurre il ricorso alla ventilazione meccanica prolungata.(23)
Uno studio multicentrico controllato su neonati di E.G. < 30 settimane affetti da RDS e sottoposti a early-NCPAP riporta che l'approccio INSURE adottato in una fase precoce dell'RDS (fabbisogno di O2 tra il 40% ed il 60%) rispetto ad un approccio più tardivo (fabbisogno di ossigeno > al 60%) si associa ad una riduzione, statisticamente significativa, della ventilazione meccanica e della mortalità nella prima settimana di vita, evidenziando quindi come un limite del fabbisogno di ossigeno > 40% possa costituire un accettabile criterio per la somministrazione del surfattante (24).
E' difficile però poter generalizzare tali strategie a bassa invasività a tutti i neonati VLBW in quanto questi rappresentano una popolazione eterogenea soprattutto per quanto riguarda l'età gestazionale, il cui ricorso alla ventilazione meccanica è inversamente proporzionale a quest'ultima (25), e l'impiego di steroidi prenatale (26).
Recentemente si è concluso uno studio prospettico randomizzato da parte del Gruppo di Studio di Pneumologia Neonatale della SIN sull'impiego profilattico della NCPAP mediante Infant Flow ai neonati con età gestazionale ≥ 28 settimane e < 32 settimane. Lo studio che ha annoverato 155 neonati (78 casi e 77 controlli) concludeva che la NCPAP applicata a scopo profilattico, iniziata entro 30 minuti dalla nascita indipendentemente dalla presenza di segni clinici di distress respiratorio, non riduce il fabbisogno di surfattante e di ventilazione meccanica nei neonati pretermine di età gestazionale compresa tra 28 e 31 settimane se confrontata con la NCPAP somministrata solo in presenza di distress respiratorio con fabbisogno di O2 > 40%.(27)
In conclusione è possibile ritenere valido un approccio sequenziale al neonato VLBW che vede in primo luogo l'impiego della NCPAP alla comparsa di segni di RDS, passando in caso d'ulteriore deterioramento clinico alla somministrazione di surfattante mentre la ventilazione meccanica rappresenta “l'ultima ratio” in caso d'insuccesso delle precedenti tecniche operative.
Effetti avversi della NCPAP
Il principale effetto avverso che può verificarsi in corso di NCPAP è l'iperdistensione polmonare correlata ad una eccessiva pressione positiva applicata ad un polmone peraltro compliante con conseguente aumentato rischio di air-leaks, mismatch V/Q, aumento del WOB e ritenzione di CO2. Inoltre di fronte a polmoni particolarmente complianti, la trasmissione della pressione positiva alle strutture mediastiniche è particolarmente elevata, con conseguente ridotto ritorno venoso al cuore e ridotto out-put cardiaco. Questo può generare ripercussioni anche a carico di altri organi ed apparati (reni, app. gastro-intestinale, cervello) specie in quei neonati con una condizione emodinamica già compromessa in partenza.
Un'altra condizione conseguente all'applicazione della NCPAP è la distensione gastrica, peraltro prevenibile mediante l'applicazione di un sondino naso-gastrico. Tale distensione, quando particolarmente accentuata, incidere sulla meccanica ventilatoria attraverso limitazioni dell'escursione diaframmatica.
Infine non bisogna dimenticare le possibili lesioni a carico dei tegumenti nasali, legati all'azione compressiva delle cannule o dispositivi vari e che a volte possono evolvere verso cicatrici permanenti (28).
A tal fine un corretto nursing da parte del personale infermieristico (efficace posizionamento, massaggi periodici delle parti compresse) riduce notevolmente il rischio di tali lesioni.
Aspetti pratici
Il valore pressorio ottimale d'ingresso per la NCPAP è solitamente compreso tra 4 e 6 cm H2O e solitamente in tali condizioni si assiste ad un miglioramento del quadro clinico del neonato con riduzione della frequenza respiratoria, abolizione del gemito espiratorio, scomparsa dei rientramenti costali. Raramente sono richiesti valori pressori superiori e comunque a questi per le intrinseche ripercussioni sul circolo e per i correlati rischi di air-leaks, vanno preferite modalità di assistenza ventilatoria più incisive. Con il sistema Infant Flow, l'unità di base che genera il flusso è soggetta ad una relazione lineare tra il flusso controllato di gas e la pressione di CPAP per cui con un flusso impostato di 7 lpm otteniamo una pressione di 4 cm di H2O entre con un flusso di 9 lpm la pressione sale a 6 cm di H2O.
La FiO2 andrà impostata e quindi variata al fine di mantenere valori di Sat.O2 compresi fra 93-96% e in ogni modo periodiche valutazioni emogasanalitiche, unitamente a valutazioni radiologiche e clinice (P.A., F.R., F.C.) serviranno per uno stretto monitoraggio dell'efficacia del trattamento attuato.
Allorquando si assiste ad un miglioramento della patologia di base bisogna provvedere allo svezzamento dalla NCPAP sia attraverso una progressiva riduzione della FiO2 (2-5% per volta fino al 21%) per i noti effetti tossici dell'iperossiemia, sia attraverso una riduzione della pressione applicata (1 cm H2O per volta fino a 2- 3 cm di H2O) per evitare fenomeni d'iperdistensione polmonare. Una volta raggiunti valori minimali per questi parametri, la terapia con NCPAP può essere sospesa più o meno progressivamente in relazione al peso e all'età gestazionale del soggetto e in rapporto alla presenza di eventuali altre indicazioni alla terapia (apnea del prematuro). Infine bisogna ricordare che grande importanza riveste il riscaldamento e l'umidificazione dei gas forniti al paziente: in genere in corso di NCPAP si consiglia impostare l'umidificatore ad una temperatura di 37°C .
Conclusioni
L'impiego estensivo della NCPAP ha un intrinseco valore clinico ovvero quello di adottare per quanto possibile una metodica certamente a bassa invasività anche nei neonati di basso peso e con bassa età gestazionale, eludendo quelle che sono le principali complicazioni legate all'impiego di trattamenti più aggressivi.
Tuttavia tale tecnica per quanto meno invasiva necessita ugualmente di elevata sorveglianza da parte del personale medico ed infermieristico in quanto le possibili complicanze o peggio il fallimento della procedura necessita di un immediato intervento correttivo.
Bibliografia
1. Orzalesi M, Dotta A. I presupposti teorici, le indicazioni e i limiti dell'utilizzo della CPAP nasale nel neonato. Atti Convegno "Assistenza respiratoria nel neonato: vecchi e nuovi approcci". Bologna , 24-25 Settembre 1997.
2. Wilson SL, Thach BT, Brouillette RT et al. Upper airway patency in the hguman infant: influence of airway pressure and posture. J Appl Physiol Respir Environ Exercise Physiol 48, 504, 1980.
3. Cohen G, Henderson-Smart D. Upper airway stability and apnea during nasal occlusion in newborn infants. J Appl Physiol 60, 1511, 1986.
4. Gauda EB, Miller MJ, Carlo W et al. Genioglossus response to airway occlusion in apneic versus non-apneic infants. Ped Res 22, 683, 1987.
5. Gerhardt T, Bancalari E. Chestwall compliance in full-term and premature infants. Acta Pediatr Scand 69, 359, 1980.
6. Schulze A, Madler HJ, Gehrhardt B et al. Titration of continuous positive airway pressure by the pattern of breathing: analysis of flow-volume time relationships by a non invasive computerized system. Pediatr Pulmonol 8, 96, 1990.
7. Gaon P, Lee S, Hannan S et al. Assessment of effect of nasal continuous poitive pressure on laryngeal opening using fobre optic laryngoscopy. Arch Dis Child Fetal Neonatal Ed 80, F230, 1999.
8. Moretti C.: Fisiopatologia respiratoria e ventilazione meccanica del neonato. Masson Ed., 1997 pg.96-97
9. Morley C. Continuous distending pressure. Arch Dis Child Fetal Neonatal Ed 81, F152, 1999.
11.Moa G., Nilsson K.: Nasal continuous positive pressure airway: experiences with a new technical approach. Acta Pediatr. 1993; 82:210
12. Hansen O. et al.: Nasal continuous positive airway pressure. Prenatal and Neonatal Medicine 1996; 1; 80
13. Avery ME, Mead J. Surface properties in relation to atelectasis and Hyaline membrane disease. Am J Dis Child 97, 517-523, 1959.
14. Greenough A., Roberton NRC. Respiratory distress syndrome. In Greenough A., Roberton NRC, Milner AD (eds): Neonatal respiratory disorders. Arnold , London 1996. Pagg. 238-279.
16. Davis P., Jankov R., Doyle L., Henschke P.: Randomised, controlled trial of nasal continuous positive airway pressure in the extubation of infants weighing 600 to 1250 gr. Arch. Dis. Child Fetal Neonatal Ed. 1998 Jul; 79 (1): F54-7
17. Jonson B., et al.: Continuous positive airway pressure: modes of action in relation to clinical application. Pediatr. Clin. North. Am. 1980; 27:687
18. Avery ME, Tooley WH, Keller JB et al. Is chronic lung disease in low birth weight infants preventable? A survey of eight centers. Pediatrics 79, 26, 1987.
19. Horbar JD, McAuliffe TL, Adler SM et al. Variability in 28-day outcomes for very low birth weight infants: an analysis of 11 neonatal intensive care units. Pediatrics 82, 554, 1988.
20. Hegyi T, Hiatt M. The effect of continuous positive airway pressure on the course of respiratory distress syndrome: the benefits of early initiation. Crit Care Med 9, 38, 1981.
21. Lundstrom KE. Initial treatment of preterm infants - continuous positive airway pressure or ventilation? Eur J Pediatr 155 (Suppl 2), S25, 1996.
22. Blennow M, Jonsson B, Dahlstrom A et al. Lung function in premature infants can be improved. Surfactant therapy and CPAP reduce the need of respiratory support. Lakartidningen 96, 1571, 1999.
23. Verder H, Robertson B, Greisen G et al. Surfactant therapy and nasal continuous positive airway pressure for newborns with respiratory distress syndrome. N Engl J Med 331, 1051, 1994.
24. Verder H, Albertsen P, Ebbesen F et al. Nasal Continuous Positive Airway Pressure and early surfactant therapy for respiratory distress syndrome in newborns of less than 30 weeks' gestation. Pediatrics 103, e24, 1999.
25. Lindner W, Vossbeck S, Hummler H et al. Delivery room management of extremely low birth weight infants: spontaneous breathing or intubation? Pediatrics 103. 961, 1999.
26. Jonsson B, Katz-Salamon M, Faxelius G et al. Neonatal Care of very low birth weight infants in special care units and neonatal intensive care units in Stockholm . Early nasal continuous positive airway pressure versus mechanical ventilation: gains and losses. Acta Pediatr Suppl 419, 4, 1997.
27. Gruppo di Studio di Pneumologia Neonatale della Società Italiana di Neonatologia. Ruolo della profilassi con NCPAP nel neonato ≥ 28 < 32 settimane. Dati preliminari. Comunicazione al II Congresso di Pneumologia Neonatale. Dr. F. Sandri Monza , 26-27 Ottobre 2000.
28. Loftus BC , Ahn J, Haddad J. Neonatal nasal deformities secondary to nasal continuous positive airway pressure. Laryngoscope 104, 1019, 1994.