
Il Monitoraggio Emodinamico col Metodo Volumetrico, una possibilità in più anche in Pediatria?
Dott.ssa
Sandra Miranda Goraieb
Specialista in Anestesiologia e Rianimazione, Sociedade
Brasileira de Anestesiologia, Associaçao de Medicina Intensiva
Brasileira
Vol 1, N. 2, Giugno 2003
L’ottimizzazione del trasporto dell’ossigeno ai tessuti in modo da soddisfare le necessità metaboliche globali e regionali è direttamente correlata alla migliore sopravvivenza del malato grave. Mantenere un adeguato flusso ematico con un supporto volemico è una modalità terapeutica essenziale e prioritaria nella cura delle diverse patologie che si presentano con un quadro di ipovolemia assoluta o relativa (emorragie, sepsi, grandi ustionati, politraumatizzati, ecc) (1).
Un problema frequente in terapia intensiva sia in adulti che in adolescenti(UTI/ PICU) è l’adeguato utilizzo dei fluidi nei pazienti gravi (2,3). L’errata valutazione dello status volemico del paziente può comportare complicanze gravi come per esempio l’edema polmonare, il ritardo nello svezzamento dalla ventilazione meccanica o il rischio di provocare un quadro d’insufficienza renale, con conseguente aumento della permanenza in UTI e della mortalità (4). Negli ultimi anni il monitoraggio emodinamico ha acquisito una importanza sempre maggiore non soltanto per l’osservazione della evoluzione clinica del malato grave, ma anche e non meno importante, per l’orientamento terapeutico nelle diverse circostanze che si possono presentare lungo il suo decorso. Con l’avvento dei cateteri di Swan-Ganz per il monitoraggio della gittata cardiaca e delle pressioni in arteria polmonare (PAC) oltre a tanti altri parametri misurati o derivati, c’è stata una maggiore applicazione dei principi fisiologici e fisiopatologici sul piano terapeutico, una volta che il medico curante poteva cambiare selettivamente il precarico o il postcarico, costruire le curve di Starling e stimare la contrattilità, senza dimenticare che la conoscenza dei gradienti pressori nel circolo polmonare capacita il medico a distinguere tra edemi cardiogeni o non cardiogeni (5). In questo ambito alcuni autori hanno provato a determinare parametri emodinamici che, una volta raggiunti, potessero diminuire la mortalità nei pazienti critici (6,7). La disponibilità di tale attrezzatura però, non è mai stata universale, sia perché molto invasiva, sia perché richiede costi particolari in materiale e personale e perché tali obiettivi sono ancora sottoposti a studi e analisi critiche (7,8,9,10,11). Inoltre, il suo utilizzo non è esente da complicazioni dovute alla incannulazione venosa centrale (come pneumotorace), alla inserzione o manutenzione del catetere (disritmie ventricolari, infarto polmonare, rottura della arteria polmonare, endocarditi) e nell’utilizzo incorretto dei dati ottenuti (5). Anche e principalmente a livello pediatrico tale monitoraggio non è stato universalmente praticato.
Verso la metà degli anni ’50 alcuni ricercatori cominciarono a sviluppare un metodo di monitoraggio non pressorico utilizzando radioisotopi legati all’albumina per determinare i volumi compartimentali. Molti furono i marcatori utilizzati, ma la tecnica si limitava agli esperimenti di laboratorio a causa della difficoltà di applicazione del metodo e della speciale attrezzatura che richiedeva per l’analisi dei campioni.
L’introduzione del verde di indocianina come marcatore e lo sviluppo di un metodo di lettura semplice e riproducibile della diluizione del doppio indicatore (sistema COLD) hanno consentito una nuova applicabilità del monitoraggio volumetrico anche al letto del paziente. In tale metodo la stima dei volumi è basata sull’applicazione simultanea di indicatori che si distribuiscono nello spazio intravascolare (indicatore non diffusibile: verde di indocianina) e negli spazi intra ed extravascolare (indicatore diffusibile: bolo freddo) rendendo possibile il calcolo dei volumi compartimentali intratoracici. Inoltre l’utilizzo del verde di indocianina, in virtù del suo metabolismo epatico, consente anche il monitoraggio della funzione epatica tramite l’analisi del PDRig (plasma disappearance rate of ICG, tasso di eliminazione plasmatica del verde di indocianina) e il CBicg (blood clearance of ICG, clearance del verde di indocianina).
Per la realizzazione della tecnica nei pazienti adulti, sono necessari il posizionamento di un catetere venoso centrale e di un catetere in un grosso vaso arterioso (preferibilmente in arteria femorale). Quest’ultimo è un catetere a fibra ottica per l’analisi della diluizione del colorante ed è provvisto di un termistore alla punta. La misurazione viene effettuata iniettando 0,3 mg/kg di verde di indocianina in un piccolo volume prescelto e conosciuto di glucosata al 5% ad una temperatura sotto i 10°C il più velocemente possibile (entro 4 secondi) nel catetere venoso centrale o nell’orifizio prossimale del catetere di Swan-Ganz (12,13). Le curve di diluizione degli indicatori sono registrate simultaneamente nell’Aorta discendente dal catetere arterioso tramite la fibra ottica (colorante) e il termistore (termica).
Per la determinazione dei volumi intratoracici sono ottenute dalla curva di diluizione i seguenti parametri: l’area della curva, che serve per la stima della gittata cardiaca, il tempo medio di attraversamento (MTt-mean transit time) e la costante di discesa della curva (DSt-downslope time). Il tempo medio di attraversamento, o Mean Transit time(MTt), è il tempo che il bolo freddo impiega per raggiungere il termistore. Il Downslope time (DSt) coincide con la costante di tempo del tratto discendente della curva di termodiluizione.
L’MTt viene utilizzato per il calcolo del volume totale disponibile all’indicatore dentro il sistema, ossia dal punto dell’ingresso alla punta del catetere, che nel caso del circolo corrisponde agli spazi intravascolari totali più il liquido extravascolare polmonare.
I parametri ottenuti dal Mean transit time (MTt) sono i seguenti: l’ITTV (IntraThoracic ThermoVolume, o termovolume intratoracico), l’ITBV (Intra Thoracic Blood Volume, o volume ematico intratoracico) e RHEDV (volume ematico telediastolico del cuore destro).
Il Downslope time (DSt) ci dà il volume della camera di mescolamento più grande tra tutte quelle attraversate dall’indicatore, ossia il volume polmonare (l’insieme degli spazi intra ed extra vascolari polmonari). I parametri ottenuti dal Downslope time (DSt) sono i seguenti: PBV (volume ematico polmonare), PTV (termovolume polmonare) e RVEDV (volume telediastolico del ventricolo destro).
Da questi calcoli si ottiene il Global End Diastolic Volume (Volume telediastolico globale, GEDV), il Left Heart End Diastolic Volume (Volume telediastolico del cuore sinistro, LHEDV), l’ Extravascular Lung Water (acqua extravascolare polmonare, EVLW). E’ importante chiarire che le misurazioni del RHEDV, del PBV, del RVEDV e del LHEDV, sono possibili soltanto utilizzando il metodo della doppia diluizione nella sua configurazione completa, ossia insieme ad un catetere in arteria polmonare (13) (fig 1).
Il verde di indocianina è selettivamente eliminato dal sangue per metabolismo epatico. Il tasso di eliminazione plasmatica (PDRig) riflette la quantità di colorante che è eliminato dopo una completa mistura, espresso in una percentuale del valore iniziale. Quindi è un indice della funzione epatica. Se la diminuzione della concentrazione plasmatica è matematicamente estrapolata al momento dell’iniezione, la concentrazione iniziale può essere stimata. Conoscendo la concentrazione iniziale del colorante nel sangue e la quantità di colorante iniettato è possibile calcolare il volume totale di sangue tramite la formula di Fick (13).
Il sistema PiCCO (Pulse Contour Continuous Cardiac Output) basato sull’analisi dell’area sotto la curva della pressione sistemica è un metodo di misurazione in continuo della gittata cardiaca e, con la tecnica della termodiluizione di un singolo indicatore diffusibile (bolo freddo), dei parametri volumetrici. Si ottengono così misurazioni in continuo del CO; della pressione arteriosa sistemica (sistolica, diastolica e media), delle resistenze vascolari sistemiche, della frequenza cardiaca e della contrattilità, oltre a valutare le condizioni volemiche del paziente in rapporto al volume telediastolico globale (GEDV, global end-diastolic volume). I seguenti parametri possono essere misurati mediante termodiluizione: Gittata Cardiaca - CO (L/m); l’Indice Cardiaco –CI (L/min/m2); l’Indice di Funzionalità Cardiaca - CFI (L/m); Volume Telediastolico Globale - GEDV (ml); e il suo valore indicizzato - GEDI (ml/m2); e inoltre sono derivati i seguenti parametri: Volume Ematico Intratoracico - ITBV (ml) e il suo valore indicizzato ITBVI (ml/m2), il Volume di Acqua Extravascolare Polmonare- EVLW e il suo valore indicizzato EVLWI (ml/kg). Per l’utilizzazione del metodo, sempre in pazienti adulti, sono necessari il posizionamento di un catetere venoso centrale e un catetere arterioso introdotto preferibilmente nell’arteria femorale. Per il catetere arterioso ci sono due possibilità: una sarebbe utilizzare un catetere 4F con doppio lume, uno per il termistore e l’altro per la pressione, oppure una cannula di 20G con valvola antireflusso, dove va inserita una sonda con il termistore (1,3F) che rileva la pressione dalla porta laterale della valvola antireflusso e la temperatura direttamente dal termistore.
La procedura di misurazione consiste nell’iniettare un bolo freddo di volume prestabilito di soluzione fisiologica o glucosio al 5% nella linea venosa centrale. Il bolo iniettato, dopo aver percorso tutto il piccolo circolo e l’aorta, raggiunge il termistore nella arteria femorale e permette la registrazione di una curva di termodiluizione che serve a determinare il CO e a calibrare il sistema.
Il sistema PiCCO misura la gittata integrando l’area sottesa dalla curva della pressione arteriosa. Questa area è proporzionale al volume di eiezione e la CO è un prodotto della frequenza cardiaca per il volume di eiezione.
Per il calcolo si utilizza un fattore di calibrazione ottenuto da un’algoritmo partendo da una misura della CO di riferimento fatta utilizzando il metodo della termodiluizione.
La gittata ottenuta dalla termodiluizione serve come valore di base per il calcolo dei volumi ematici e dell’acqua polmonare extravascolare. Per esempio, se il contenuto di acqua polmonare è normale la curva di termodiluizione arteriosa periferica è da quattro a cinque volte più lunga della curva di termodiluizione misurata in arteria polmonare. Quanto maggiore è la quantità di acqua sequestrata nei polmoni tanto più si allunga la curva. Poiché la misurazione in arteria sistemica necessita di un tempo di circolo più lungo di quella misurata in arteria polmonare certi fattori che influenzano la sua misura incidono di meno sulla precisione del dato, come ad esempio il ciclo respiratorio. In questo caso, la misura del CO in arteria sistemica corrisponderebbe al suo valore medio durante il ciclo respiratorio.
Il sistema PiCCO non è idoneo per la misurazione dell’ITBV e del PBV, che a loro volta consentono il calcolo dell’EVLW, poiché non dispone del componente non diffusibile del calcolo. I parametri misurati dal sistema PiCCO includono soltanto l’ITTV (termovolume Intratoracico) e il PTV (termovolume polmonare). Perciò gli altri parametri vengono stimati in base al GEDV, una volta stabilito che esiste una relazione lineare tra ITBV e GEDV. Sakka et al. studiarono tali parametri utilizzando il metodo matematico dell’analisi di regressione strutturale e conclusero che i valori ottenuti col metodo PiCCO corrispondono a quelli misurati con la tecnica del doppio indicatore (14).
Il GEDV, o volume telediastolico globale è un indice affidabile del precarico e il rapporto tra la gittata e il GEDV a sua volta è un indicatore della performance cardiaca (indipendente dal precarico) e viene chiamato indice di funzionalità cardiaca (CFI, cardiac function index).
L’interpretazione delle misure di pressione come la CVP e la PCWP per indicare il precarico cardiaco non è accurata. Dipende da molte variabili quali: la pressione di riempimento, la pressione intratoracica, la compliance arteriosa e la contrattilità del ventricolo. Condizioni queste che nel malato grave possono essere molto alterate sia dalla patologia stessa che dai mezzi terapeutici utilizzati. Invece il GEDV essendo un indice volumetrico puro, non subisce queste interferenze.
La determinazione del volume intratoracico nel sistema PiCCO, come già detto precedentemente, viene stimata tramite derivazioni dei valori del GEDV. L’ITBV comprende sia il GEDV che il PBV, ossia il valore di riempimento del cuore a fine diastole sommato al volume ematico polmonare più il sangue che si trova dentro l’Aorta fino al punto del termistore.
Per meglio capire l’importanza clinica dell’ITBV definiremo ipo e ipervolemia relativa e assoluta. Nel torace si possono stabilire tre volumi variabili che possono influenzarsi reciprocamente a causa della sua limitata capacità di espansione, ossia: volume di sangue intratoracico, volume di gas intratoracico e il volume di acqua extravascolare polmonare. Un possibile quarto compartimento potrebbe essere occupato da masse tumorali, contusioni e versamenti. L’ipervolemia o ipovolemia assoluta fa riferimento ai casi in cui esiste una modificazione della volemia totale (TBV) senza che ci sia una modificazione del rapporto ITBV/TBV, mentre nel caso di ipo o ipervolemia relativa i valori del TBV si mantengono nella norma mentre il rapporto tra ITBV e TBV viene alterato.
Il valore dell’ITBV può essere ridotto a seguito di una ipovolemia assoluta per emorragia, oppure di una ipovolemia relativa per applicazione di una PEEP, negli edemi polmonari, nei pneumotoraci e nei versamenti pleurici o quando ci sia uno squilibrio nei compartimenti toracici.
Il valore dell’ITBV è un indicatore di precarico abbastanza preciso. Molti autori hanno evidenziato la sua superiorità come parametro emodinamico nel confronto fra la PVC e la PCWP e il RVEDV (volume telediastolico ventricolare destro) (15,16,17,18). Recentemente alcuni autori hanno affermato la sua affidabilità come parametro emodinamico nella Sepsi (19) nel periodo postoperatorio generale(20), nei trapianti (21,22) e nella popolazione pediatrica(23).
Lichtwarck-Aschoff et al. affermano che l’utilizzo delle pressioni non ha nessuna correlazione con l’effettivo riempimento nei pazienti ventilati artificialmente (16,17), concetto importantissimo per i pazienti ricoverati in ICU o sottoposti ad interventi chirurgici in anestesia generale.
L’importanza della stima dell’EVLW dal punto di vista clinico è che essa rispecchiando il compartimento extravascolare, può guidare la terapia dei fluidi più accuratamente evitando l’edema polmonare non cardiogeno (24).
L’EVLW aumentata può essere contrastata con un bilancio idrico negativo dei fluidi. Però è importante considerare che al di sotto di un valore normale di ITBV una ulteriore riduzione dei fluidi non altera l’EVLW, potendo invece ridurre la gittata e l’offerta di ossigeno ai tessuti con tutti gli effetti indesiderabili conseguenti.
Il volume di acqua nei polmoni aumenta nei casi di insufficienza cardiaca, polmonite, sepsi, intossicazione, ustioni, ARDS. L’EVLW aumenta a causa di un aumento della pressione intravascolare o di un aumento della permeabilità vascolare polmonare. Il rapporto tra il volume di acqua extravascolare polmonare e il volume di sangue polmonare (EVLW/PBV) è un indice preciso di permeabilità dei capillari polmonari e esprime anche il grado di danno della membrana capillare e lo stato dei polmoni, col vantaggio di poter essere valutato al letto del paziente.
Le limitazioni della tecnica di termodiluizione semplice sono simili a quelle del doppio indicatore. I volumi saranno sovrastimati in presenza di grandi aneurismi aortici o di cateteri locati molto distalmente, come per esempio nell’arteria radiale per un MTt molto allargato. Shunt intracardiaci possono limitare l’uso di questa tecnica. Una bassa CO o la presenza di anomalie severe della perfusione polmonare, tipo una macroembolizzazione, possono compromettere le misurazioni dell’EVLW. Qualsiasi alterazione della normale vascolarizzazione dei polmoni, come nei casi di pneumectomia, possono condurre ad un errore di valutazione nel PBV e conseguentemente anche dell’ITBV (14,17).
Un’altra limitazione per la lettura dei parametri in continuo sono le aritmie come il flutter o la fibrillazione atriale. Questo è dovuto al fatto che il monitoraggio delle pressioni avviene correttamente quando il sensore del battito pulsa in concomitanza con il ritmo cardiaco e soltanto quando il segnale è stabile è possibile effettuare una analisi precisa del contorno del polso. Nelle aritmie i valori presentano grande variazione e a volte sono addirittura incalcolabili.
Ricapitolando, i fattori che influenzano le tecniche di termodiluizione includono (14,25):
a)cause dovute al paziente
· Movimento o cambiamento nella posizione del catetere possono alterare il ritorno venoso al cuore
· Malattia valvolare della tricuspide o insufficienza polmonare riducono la affidabilità per ricircolo del sangue
· Shunt intrapolmonari o intracardiaci
· Aritmie
· Aneurismi aortici possono elevare artificialmente il GEDV
· anomalie della perfusione polmonare, macroembolie, riduzione della vascolarizzazione polmonare
· la presenza di placche o ostruzioni possono falsare i valori misurati
b) fattori dovuti all’iniezione del bolo
· l’area sotto la curva di termodiluizione è proporzionalmente minore se il volume iniettato è minore del valore utilizzato dall’operatore per calibrare il sistema. Questo potrà provocare una sovrastima della gittata. Un errore di circa 0,5ml nel volume iniettato provoca dal 5 al 10% di errore nelle misurazioni
· La velocità di iniezione deve essere entro 4 secondi o meno. Il tempo prolungato della velocità di iniezione interferisce con le costanti di calcolo del computer.
· Temperature di iniezioni superiori a 10°C sono fonte di errori
c) fattori dovuti al termistore
· la punta del termistore deve essere posta nel centro della arteria
· il termistore non deve essere posizionato in un vaso troppo periferico perché così il tempo di attraversamento del bolo sarà prolungato e conseguentemente le misure da esse derivate saranno falsate
· la presenza di trombi nel catetere produrrà errori proporzionali alla misura del trombo stesso.
d) altre cause di errore sono
· inabilità dell’operatore del sistema
· malfunzionamento dell’apparecchio
· uso di costanti inadeguate o dimenticanza di inserimento di dati aggiornati del paziente.
Le complicazioni derivanti dall’applicazione del metodo volumetrico sono di carattere vascolari, sia dovute alla punzione dei vasi necessari al posizionamento dei cateteri, sia i generali come infezioni degli stessi cateteri, il che non è infrequente.
Conclusioni:
Siccome il metodo volumetrico è stato ancora limitato a pochi casi pediatrici sarebbe interessante se gli specialisti nell’intensivismo pediatrico potessero meglio valutare la sua validità e la sua utilità in questa popolazione, dato che i risultati pubblicati nella letteratura in una popolazione adulta sono soddisfacenti. Se si rivelasse un metodo davvero efficace potrebbe diventare un valido ausilio negli ambienti pediatrici una volta considerati i rischi inerenti alla sua applicazione e i benefici da essi derivati.
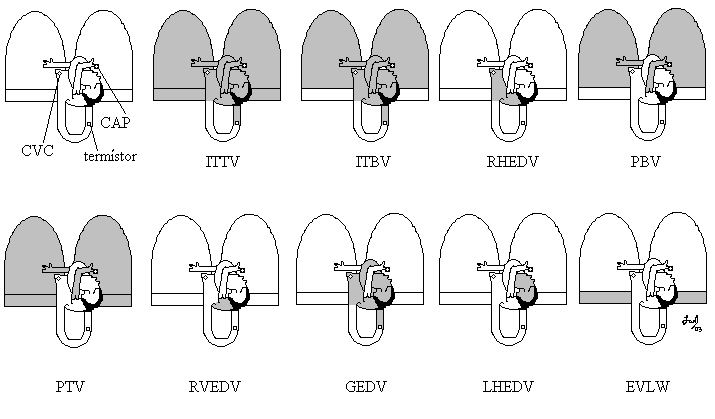
figura 1. Rappresentazione grafica dei compartimenti misurati con i metodi volumetrici
Bibliografia
1) Fernandes Jr. C J et al.: Reposição Volemica. in Knobel E.(ed): Condutas no Paciente Grave Livraria Atheneu Editora, S.Paulo, 1994; pp:112-119
2) Vincent JL, Preiser JC: Inotropic agents. New Horizons 1993;1:137-144
3) Hill SL, Elings VB, Lewis FR: Changes in lung water and capillary permeability following sepsis and fluid overload. J Surg Res 1980;28:140-150
4) Shoemaker W C , Parsa M H : Invasive and non Invasive Physiologic Monitoring. in Shoemaker (ed): Textbook of Critical Care 3° ed. W.B.Saunders, Philadelphia,1995; pp:252-266
5) Ginosar Y, Sprung CL: The Swan Ganz Catheter. Twenty-five years of monitoring. Clinical Care Clinics 1996; 12(4):771-775
6) Shoemaker WC, Appel PL, Kram HB et al: Prospective trial of supranormal values of survivors as therapeutic goals in high-risk surgical patients. Chest 1988;94:1176-1186
7) Boyd O, Bennett ED : Enhancement of perioperative tissue perfusion as a therapeutic strategy for major surgery. New Horizons 1996; 4 (4): 453-465
8) Shoemaker WC, Belzberg H, Gutierrez G et al.: Recent advances in invasive and noninvasive monitoring. New Horizons 1996; 4(4): 393-4
9) Walker MB, Waldman CS: The use of pulmonary artery catheters in intensive care: time for reappraisal? Clin Intensive Care 1994;5(1):15-19
10) Hanson III CW: Pulmonary artery catheter usefulness explored by consortium of societies. ASA Newsletter 2000;64(3):6-7
11) Bernard GR, Sopko G, Cerra F et al: Pulmonary artery catheterization and clinical outcomes. National Heart, Lung and Blood Institute and Food and Drug Administration Workshop Report. JAMA 2000;283(19):2568-72
12) Boyle III J: Indicator mixing in the left heart and reexamination of mean circulation time. J Appl Physiol 1974;4:541-6
13) Godje O, Peyerl M, Seebauer T et al.: Reproducibility of double indicator dilution measurements of intrathoracic blood Volume compartments, extravascular lung water and liver function. Chest 1998; 113(4): 1070-77
14) Sakka SG, Ruhl CC, Pfeiffer UJ et al : Assessment of cardiac preload and extravascular lung water by single transpulmonary thermodilution. Intensive Care Med 2000; 26:180-187
15) Hedenstierna G: What value does the recording of intrathoracic blood volume have in clinical practice? Intensive Care Med 1992; 18 : 137-8
16) Lichtwarck-Aschoff M, Zeravik j, Pfeiffer UJ: Intrathoracic blood volume accurately reflects circulatory volume status in critically ill patients with mechanical ventilation. Intensive Care Med 1992; 18 : 142-147
17) Lichtwarck-Aschoff M, Beale R, Pfeiffer UJ: Central Venous Pressure, Pulmonary Artery Oclusion Pressure, Intrathoracic Blood Volume, and Right End Diastolic Volume as indicators of Cardiac Preload. Journal of Critical Care 1996; 11 (4): 180-188
18) Hoeft A, Schorn B et al Bedside Assessment of intravascular volume status in patients undergoing coronary bypass surgery. Anesthesiology 1994; 81(1)76-86
19) Boussat S, Jacques T, Levy B, Laurent E, Gache A, Capellier G, Neidhardt A. Intravascular volume monitoring and extravascular lung water in septic patients with pulmonary edema. Intensive Care Med 2002 Jun;28(6):712-8
20) Brock H, Gabriel C, Bibl D, Necek S. Monitoring intravascular volumes for postoperative volume therapy. Eur J Anaesthesiol 2002 Apr;19(4):288-94
21) Della Rocca G, Costa GM, Coccia C, Pompei L, Di Marco P, Pietropaoli P. Preload index: pulmonary artery occlusion pressure versus intrathoracic blood volume monitoring during lung transplantation. Anesth Analg 2002 Oct;95(4):835-43
22) Della Rocca G, Costa MG, Coccia C, Pompei L, Pietropaoli P. Preload and haemodynamic assessment during liver transplantation: a comparison between the pulmonary artery catheter and transpulmonary indicator dilution techniques. Eur J Anaesthesiol 2002 Dec;19(12):868-75
23) Schiffmann H, Erdlenbruch B, Singer D, Singer S, Herting E, Hoeft A, Buhre W. Assessment of cardiac output, intravascular volume status, and extravascular lung water by transpulmonary indicator dilution in critically ill neonates and infants. J Cardiothorac Vasc Anesth 2002 Oct;16(5):592-7
24) Eisenberg PR, Hansbrough JR et al A prospective study of lung water measurement during patient management in an intensive care unit. Am. Rev. Resp. Dis 1987;136:662-668
25) Ronan KP: Factors affecting thermodilution Cardiac Output. pp 268-9 in Faust R J (ed) : Anesthesiology Review 2° ed. Churchill Livingstone, 1994